Амфифильные N-олигоэтиленгликоль-имидазолиевые производные п-трет-бутилтиакаликc[4]арена: синтез, агрегация и взаимодействие с ДНК
Аннотация
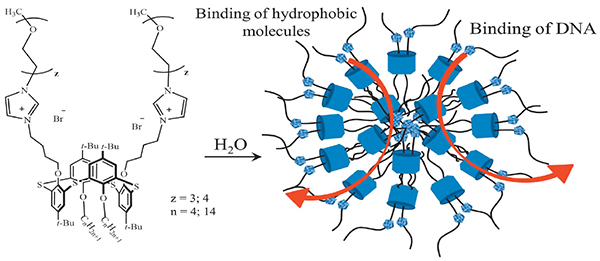
Синтезированы новые водорастворимые производные п-трет-бутилтиакаликс[4]арена в стереоизомерной форме 1,3-альтернат с бутильными и тетрадецильными группами c одной стороны макроциклической платформы и три/тетраэтиленгликолевыми заместителями – с другой. Исследованы агрегационные характеристики макроциклов в водной среде (ККА, размеры агрегатов, дзета-потенциал). Продемонстрировано, что образующиеся агрегаты обладают способностью солюбилизировать липофильный азокраситель Оранж ОТ, причем солюбилизирующая способность существенно возрастает при переходе от бутил- к тетрадецилпроизводным. С помощью методов динамического и электрофоретического рассеяния света и флуориметрии с бромистым этидием в качестве зонда показано, что полученные макроциклы взаимодействуют с ДНК тимуса теленка. Установлено, что на эффективность взаимодействия большое влияние оказывает длина оксиэтильных фрагментов: макроциклы, содержащие тетраэтиленгликолевые фрагменты более эффективны по сравнению с триэтиленгликолевыми аналогами, вызывая 2-кратную компактизацию ДНК.
Литература
Chowdhury S., Rakshit A., Acharjee A., Saha B. ChemistrySelect 2019, 4, 6978-6995. https://doi.org/10.1002/slct.201901160
Li H., Zhao J., Wang A., Li Q., Cui W. Colloids Surf. A. 2020, 590, 24486. https://doi.org/10.1016/j.colsurfa.2020.124486
Muraoka T., Honda H., Nabeya K., Kinbara K. Chem. Commun. 2020, 56, 7881-7884. https://doi.org/10.1039/D0CC02716B
Schramm L.L., Stasiuk E.N., Marangoni D.G. Annu. Rep. Prog. Chem., Sect. C: Phys. Chem. 2003, 99, 3-48. https://doi.org/10.1039/B208499F
Kulkarni C. Cosmetics 2016, 3(4), 37. https://doi.org/10.3390/cosmetics3040037
Encyclopedia of Membranes (Drioli E., Giorno L., Eds.), Springer, Berlin, Heidelberg 2014, 60 p.
Seo S.H., Tew G.N., Chang J.Y. Soft Matter 2006, 2, 886-891. https://doi.org/10.1039/b606870g
Zhang B., Jiang Z., Zhou X., Lu S., Li J., Liu Y., Li C. Angew. Chem. 2012, 124, 13336-13339. https://doi.org/10.1002/ange.201206438
Ibragimova, R.R., Burilov V.A., Aimetdinov A.R., Mironova D.A., Evtugyn V.G., Osin Y.N., Solovieva S.E., Antipin I.S. Macroheterocycles 2016, 9, 433-441. https://doi.org/10.6060/mhc161180b
Burilov V., Garipova R., Sultanova E., Mironova D., Grigoryev I., Solovieva S., Antipin I. Nanomaterials 2020, 10(6), 1143. https://doi.org/10.3390/nano10061143
Parshad B., Prasad S., Bhatia S., Mittal A., Pan Y., Mishra P.K., Sharma S.K., Fruk L. RSC Adv. 2020, 10, 42098-42115. https://doi.org/10.1039/D0RA08092F
Kashapov R.R., Razuvayeva Y.S., Ziganshina A.Y., Mukhitova R.K., Sapunova A.S., Voloshina A.D., Zakharova L.Ya. Macroheterocycles 2019, 12, 346-349. https://doi.org/10.6060/mhc190549k
Kashapov R.R., Gaynanova G.A., Gabdrakhmanov D.R., Kuznetsov D.M., Pavlov R.V., Petrov K.A., Zakharova L.Y., Sinyashin O.G. Int. J. Mol. Sci. 2020, 21, 6961. https://doi.org/10.3390/ijms21186961
Burilov V.A., Ibragimova R.R., Gafiatullin B.H., Nugmanov R.I., Solovieva S.E., Antipin I.S. Macroheterocycles 2017, 10, 215-220. https://doi.org/10.6060/mhc170514b
Armarego W.L.F., Chai C.L.L. Purification of Laboratory Chemicals, 6th ed., Butterworth-Heinemann, 2009. 743 p.
Burilov V.A., Nugmanov R.I., Ibragimova R.R., Solovieva S.E., Antipin I.S. Mendeleev Commun. 2015, 25, 177-179. https://doi.org/10.1016/j.mencom.2015.05.005
Bara J.E. Ind. Eng. Chem. Res. 2011, 50, 13614-13619. https://doi.org/10.1021/ie070437g
Yan M., Li B., Zhao X. Food Chem. 2010, 122, 1333-1337. https://doi.org/10.1016/j.foodchem.2010.03.102
Aguiar J., Carpena P., Molina-Bolıvar J.A., Ruiz C.C. Colloid Interface Sci. 2003, 258, 116-122. https://doi.org/10.1016/S0021-9797(02)00082-6
Israelachvili J. N., Mitchell D.J., Ninham B.W. J. Chem. Soc. Faraday Trans. 1976, 72, 1525-1568. https://doi.org/10.1039/f29767201525
Arimori S., Nagasaki T., Shinkai S. J. Chem. Soc. Perkin Trans. 2. 1995, 887, 679-683. https://doi.org/10.1039/c39950000961
Burilov V.A., Mironova D.A., Ibragimova R.R., Solovieva S.E., Konig B., Antipin I.S. RSC Adv. 2015, 5, 101177-101185. https://doi.org/10.1039/C5RA18294H
Tehrani-Bagha A.R., Holmberg K. Materials 2013, 6, 580-608. https://doi.org/10.3390/ma6020580
Zhiltsova E.P., Pashirova T.N., Ibatullina M.R., Lukashenko S.S., Gubaidullin A.T., Islamov D.R., Kataeva O.N., Kutyreva M.P., Zakharova L.Y. Phys. Chem. Chem. Phys. 2018, 20, 12688-12699. https://doi.org/10.1039/C8CP01954A
Kashapov R. R., Kharlamov S. V., Sultanova E. D., Mukhitova R. K., Kudryashova Y. R., Zakharova L. Y., Ziganshina A. Y., Konovalov A. I. Chem.-Eur. J., 2014, 20, 14018. https://doi.org/10.1002/chem.201403721
Zakharova L.Y., Kashapov R.R., Pashirova T.N., Mirgorodskaya A.B., Sinyashin O.G. Mendeleev Commun. 2016, 26, 457-468. https://doi.org/10.1016/j.mencom.2016.11.001
Zakharova L.Y., Gaysin N.K., Gnezdilov O.I., Bashirov F.I., Kashapov R.R., Zhiltsova E.P., Pashirova T.N., Lukashenko S.S. J. Mol. Liq. 2012, 167, 89-93. https://doi.org/10.1016/j.molliq.2011.12.015
Gainanova G.A., Vagapova G.I., Syakaev V.V., Ibragimova A.R., Valeeva F.G., Tudriy E.V., Galkina I.V., Kataeva O.N., Zakharova L.Ya., Latypov S.K., Konovalov A.I. J. Colloid Interface Sci. 2012, 367, 327-336. https://doi.org/10.1016/j.jcis.2011.10.074
Kuznetsova D.A., Gabdrakhmanov D.R., Kuznetsov D.M., Lukashenko S.S., Sapunova A.S., Voloshina A.D., Nizameev I.R., Kadirov M.K., Zakharova L.Y. J. Mol. Liq. 2020, 319, 114094. https://doi.org/10.1016/j.molliq.2020.114094
Ostos F.J., Lebron J.A., Moyá M.L., Deasy M., López-Cornejo P. Colloids Surf. 2015, 127, 65-72. https://doi.org/10.1016/j.colsurfb.2015.01.019
Rodik R.V., Anthony A.S., Kalchenko V.I., Mély Y., Klymchenko A.S. New J. Chem. 2015, 39, 1654-1664. https://doi.org/10.1039/C4NJ01395F
Zhou C.Y., Zhao J., Wu Y.B., Yin C.X., Pin Y. J. Inorg. Biochem. 2006, 101, 10-18. https://doi.org/10.1016/j.jinorgbio.2006.07.011
Guo Q., Lu M., Marky L.A., Kallenbach N.R. Biochemistry 1992, 31, 2451-2455. https://doi.org/10.1021/bi00124a002
Izumrudov V.A., Zhiryakova M.V., Goulko A.A. Langmuir 2002, 18, 10348-10356. https://doi.org/10.1021/la020592u
Samarkina D.A., Gabdrakhmanov D.R., Lukashenko S.S., Khamatgalimov A.R., Kovalenko V.I., Zakharova L.Y. Colloids Surf. A 2017, 529, 990-997. https://doi.org/10.1016/j.colsurfa.2017.07.018
Shi P., Jianga Q., Zhang Q., Tian Y. J. Organomet. Chem. 2016, 804, 66-72. https://doi.org/10.1016/j.jorganchem.2015.12.017
Kumara V., Naik V.G., Das A., Bal S.B., Biswas M., Kumar N., Ganguly A., Chatterjee A., Banerjee M. Tetrahedron 2019, 75, 3722-3732. https://doi.org/10.1016/j.tet.2019.05.044