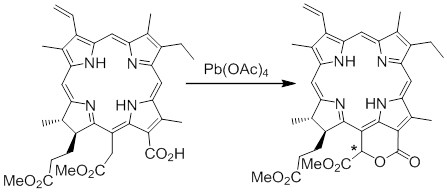
Окислительная лактонизация диметилового эфира хлорина e6
Аннотация
Обнаружена новая трансформация 15(2),17(3)-диметилового эфира хлорина е6, приводящая к его 13(1),15(1)-лактонному производному. Реакция протекает при обработке субстрата тетраацетатом свинца в присутствии LiCl, в ходе которой происходит окислительная циклизация с образованием лактонного цикла, сочлененного с терапиррольным макроциклом в положениях 13 и 15. Предложен механизм реакции, проведены квантово-химические расчеты для обоснования механизма.
Литература
Shi Y., Zhang F., Linhardt R.J. Dyes Pigm. 2021, 188, 109136. https://doi.org/10.1016/j.dyepig.2021.109136
Ethirajan M., Chen Y., Joshi P., Pandey R.K. Chem. Soc. Rev. 2011, 40, 340-362. https://doi.org/10.1039/B915149B
Allison R.R., Sibata C.H. Photodiagn. Photodyn. Ther. 2010, 7(2), 61-75. https://doi.org/10.1016/j.pdpdt.2010.02.001
Glowacka-Sobotta A., Wrotynski M., Kryjewski M., Sobotta L., Mielcarek J. J. Porphyrins Phthalocyanines 2019, 23(01n02), 1-10. https://doi.org/10.1142/S108842461850116X
Koifman O.I., Ageeva T.A., Kuzmina N.S., Otvagin V.F., Nyuchev A.V., Fedorov A.Yu., Belykh D.V., Lebedeva N.Sh., Yurina E.S., Syrbu S.A., Koifman M.O., Gubarev Y.A., Bunin D.A., Gorbunova Yu.G., Martynov A.G., Tsivadze A.Yu., Dudkin S.V., Lyubimtsev A.V., Maiorova L.A., Kishalova M.V., Petrova M.V., Sheinin V.B., Tyurin V.S., Zamilatskov I.A., Zenkevich E.I., Morshnev P.K., Berezin D.B., Drondel E.A., Kustov A.V., Pogorilyy V.A., Noev A.N., Eshtukova-Shcheglova E.A., Plotnikova E.A., Plyutinskaya A.D., Morozova N.B., Pankratov A.A., Grin M.A., Abramova O.B., Kozlovtseva E.A., Drozhzhina V.V., Filonenko E.V., Kaprin A.D., Ryabova A.V., Pominova D.V., Romanishkin I.D., Makarov V.I., Loschenov V.B., Zhdanova K.A., Ivantsova A.V., Bortnevskaya Yu.S., Bragina N.A., Solovieva A.B., Kuryanova A.S., Timashev P.S. Macroheterocycles 2022, 15, 207-302. https://doi.org/10.6060/mhc224870k
van der Haas R.N.S., de Jong R.L.P., Noushazar M., Erkelens K., Smijs T.G.M., Liu Y., Gast P., Schuitmaker H.J., Lugtenburg J. Eur. J. Org. Chem. 2004, 2004, 4024-4038. https://doi.org/10.1002/ejoc.200400366
Kozyrev A.N., Chen Y., Goswami L.N., Tabaczynski W.A., Pandey R.K. J. Org. Chem. 2006, 71, 1949-1960. https://doi.org/10.1021/jo052334i
Yano T., Minamide T., Takashima K., Nakajo K., Kadota T., Yoda Y. J. Clin. Med. 2021, 10, 2785. https://doi.org/10.3390/jcm10132785
Kustov A.V., Smirnova N.L., Privalov O.A., Moryganova T.M., Strelnikov A.I., Morshnev P.K., Koifman O.I., Lyubimtsev A.V., Kustova T.V., Berezin D.B. J. Clin. Med. 2022, 11, 233. https://doi.org/10.3390/jcm11010233
Pucci C., Martinelli C., Degl'Innocenti A., Desii A., De Pasquale D., Ciofani G. Macromol. Biosci. 2021, 21, 2100181. https://doi.org/10.1002/mabi.202100181
Hur J., Jang J., Sim J. Int. J. Mol. Sci. 2021, 22, 2769. https://doi.org/10.3390/ijms22052769
Shaw S.J., Sundermann K.F., Burlingame M.A., Myles D.C., Freeze B.S., Xian M., Brouard I., Smith A.B. J. Am. Chem. Soc. 2005, 127, 6532-6533. https://doi.org/10.1021/ja051185i
Yin Jungang W. Z., Yang Zea, Liu Chao, Zhao Lili, Wang Jinjun Chin. J. Org. Chem. 2012, 32, 360-367. https://doi.org/10.6023/cjoc1108301
Hargus J.A., Fronczek F.R., Vicente M.G.H., Smith K.M. Photochem. Photobiol. 2007, 83, 1006-1015. https://doi.org/10.1111/j.1751-1097.2007.00092.x
Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani, G.; Barone, V.; Mennucci, B.; Petersson, G. A.; Nakatsuji, H.; Caricato, M.; Li, X.; Hratchian, H. P.; Izmaylov, A. F.; Bloino, J.; Zheng, G.; Sonnenberg, J. L.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Montgomery, J. A. J.; Peralta, J. E.; Ogliaro, F.; Bearpark, M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Keith, T.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Rega, N.; Millam, J. M.; Klene, M.; Knox, J. E.; Cross, J. B.; Bakken, V.; Adamo, C.; Jaramillo, J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Zakrzewski, V. G.; Voth, G. A.; Salvador, P.; Dannenberg, J. J.; Dapprich, S.; Daniels, A. D.; Farkas, O.; Foresman, J. B.; Ortiz, J. V.; Cioslowski, J.; Fox, D. J. Gaussian 09, Revision D.01, Gaussian, Inc., Wallingford CT: 2013.
Belyaev E.S., Kozhemyakin G.L., Tyurin V.S., Frolova V.V., Lonin I.S., Ponomarev G.V., Buryak A.K., Zamilatskov I.A. Org. Biomol. Chem. 2022, 20, 1926-1932. https://doi.org/10.1039/D1OB02005F
Kozhemyakin G.L., Tyurin V.S., Shkirdova A.O., Belyaev E.S., Kirinova E.S., Ponomarev G.V., Chistov A.A., Aralov A.V., Tafeenko V.A., Zamilatskov I.A. Org. Biomol. Chem. 2021, 19, 9199-9210. https://doi.org/10.1039/D1OB01626A
Lonin I.S., Kuzovlev A.S., Belyaev E.S., Ponomarev G.V., Koifman O.I., Tsivadze A.Y. J. Porphyrins Phthalocyanines 2014, 18, 123-128. https://doi.org/10.1142/S108842461350123X
Varenikov A., Shapiro E., Gandelman M. Chem. Rev. 2021, 121, 412-484. https://doi.org/10.1021/acs.chemrev.0c00813
Kochi J.K. J. Org. Chem. 1965, 30, 3265-3271. https://doi.org/10.1021/jo01021a002
Kochi J.K. J. Am. Chem. Soc. 1965, 87, 2500-2502. https://doi.org/10.1021/ja01089a041
Hu X.-Q., Liu Z.-K., Hou Y.-X., Gao Y. iScience 2020, 23 (7), 101266. https://doi.org/10.1016/j.isci.2020.101266
Chateauneuf J., Lusztyk J., Ingold K.U. J. Am. Chem. Soc. 1988, 110, 2886-2893. https://doi.org/10.1021/ja00217a032
Zhang S., Li L., Wang H., Li Q., Liu W., Xu K., Zeng C. Org. Lett. 2018, 20, 252-255. https://doi.org/10.1021/acs.orglett.7b03617