Количественное определение хлорофилла а в биомассе спирулины с помощью ЯМР 1H
Аннотация
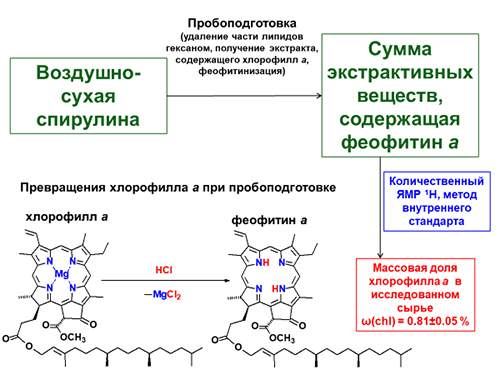
Предложена методика определения массовой доли хлорофилла а в биомассе спирулины – сырья для получения производных хлорофилла а – с использованием спектроскопии ЯМР 1Н без предварительного разделения компонентов экстракта (получен при исчерпывающем экстрагировании смесью хлороформа с этанолом). Ввиду относительной лабильности хлорофилла а для его определения проводили деметаллирование в мягких условиях (действием на экстракт 10 % соляной кислоты) с образованием более устойчивого феофитина а, который и служил дериватом для определения хлорофилла а. Массовую долю хлорофилла а в исследуемом сырье вычисляли исходя из количества феофитина а в экстракте. Определение содержания феофитина а в анализируемом экстракте для расчета массовой доли хлорофилла а в воздушно-сухой биомассе спирулины проведено методом внутреннего стандарта. В качестве внутреннего стандарта был использован 4-нитробензальдегид. Соотношение количества феофитина а и добавленного в экстракт 4-нитробензальдегида определяли по интегральным интенсивностям сигналов протонов внутреннего стандарта и протонов в мезо-положениях молекулы феофитина а. Показано, что для повышения точности определения полезно предварительное удаление части липидных компонентов экстракцией гексаном. Массовая доля хлорофилла а в исследуемом сырье составила ω(chl) = 0.81±0.05 %. Полученный результат соответствует данным о препаративных выходах феофитина а и метилфеофорбида а, полученных из этого же образца спирулины (по выходам этих соединений можно судить о нижней границе содержания хлорофилла а в сырье). Предложенная методика может быть адаптирована для других видов сырья, содержащих хлорофилл а или его производные.
Литература
Imran M., Muhammad M., Kaleem Qureshi A.K., Khan M.A., Tariq M. Biosensors 2018, 8, 95. https://doi.org/10.3390/bios8040095
Abrahamse H., Hamblin M.R. Biochem. J. 2016, 473(4), 347-364. https://doi.org/10.1042/BJ20150942
Van Straten D., Mashayekhi V., de Bruijn H.S., Oliveira S., Robinson D.J. Cancers 2017, 9, 19. https://doi.org/10.3390/cancers9020019
Ormond A.B., Freeman H.S. Materials 2013, 6(3), 817-840. https://doi.org/10.3390/ma6030817
Hamblin M.R. Curr. Opin. Microbiol. 2016, 33, 67-73. https://doi.org/10.1016/j.mib.2016.06.008
Kustov A.V., Kustova T.V., Belykh D.V., Khudyaeva I.S., Berezin D.B. Dyes and Pigments 2020, 173, 107948. https://doi.org/10.1016/j.dyepig.2019.107948
Osati S., Ali H., Guérin B., van Lier J.E. J. Porphyrins Phthalocyanines 2017, 21, 701-730. https://doi.org/10.1142/S108842461730004X
Glowacka-Sobotta A., Wrotynski M., Kryjewski M., Sobotta L., Mielcarek J. J. Porphyrins Phthalocyanines 2019, 23, 1-10. https://doi.org/10.1142/S108842461850116X
Aggarwal A., Samaroo D., Jovanovic I.R., Singh S., Tuz M.P., Mackiewicz M.R. J. Porphyrins Phthalocyanines 2019, 23, 741-765. https://doi.org/10.1142/S1088424619300118
Singh S., Aggarwal A., N.V.S. Dinesh K. Bhupathiraju, Arianna G., Tiwari K., Drain C.M. Chem. Rev. 2015, 115(18), 10261-10306. https://doi.org/10.1021/acs.chemrev.5b00244
Lovell J.F., Tracy W.B. Liu, Chen J., Zheng G. Chem. Rev. 2010, 110, 2839-2857. https://doi.org/10.1021/cr900236h
Tkachenko N.V., Tauber A.Y., Grandell D., Hynninen P.H., Lemmetyinen H. J. Phys. Chem. A 1999, 103, 3646-3656. https://doi.org/10.1021/jp983765q
Boxer S.G., Closs G.L. J. Am. Chem. Soc. 1976, 98, 5406-5408. https://doi.org/10.1021/ja00433a066
Wasielewski M.R., Svec W.A., Cope B.T. Am. Chem. Soc. 1978, 100, 1961-1962. https://doi.org/10.1021/ja00474a070
Boxer S.G., Bucks R.R. Am. Chem. Soc. 1979, 101, 1883-1885. https://doi.org/10.1021/ja00501a045
Liddell P.A., Barrett D., Makings L.R., Pessiki P.J., Gust D., Moore T.A. Am. Chem. Soc. 1986, 108, 5350-5352. https://doi.org/10.1021/ja00277a053
Wiederrecht G.P., Niemczyk M.P., Svec W.A., Wasielewski M.R. J. Am. Chem. Soc. 1996, 118, 81-88. https://doi.org/10.1021/ja953159y
Kelley R.F., Tauber M.J., Wasielewski M.R. J. Am. Chem. Soc. 2006, 128, 4779-4791. https://doi.org/10.1021/ja058233j
Panda M.K., Ladomenou K., Coutsolelos A.G. Coord. Chem. Rev. 2012, 256, 2601-2627. https://doi.org/10.1016/j.ccr.2012.04.041
Amao Y., Komori T. Biosens. Bioelectron. 2004, 19, 843-847. https://doi.org/10.1016/j.bios.2003.08.003
Amao Y., Yamada Y. Biosens. Bioelectron. 2007, 22, 1561-1565. https://doi.org/10.1016/j.bios.2006.07.006
Alekseev A.S., Tkachenko N.V., Tauber A.Y., Hynninen P.H., Osterbacka R., Stubb H., Lemmetyinen H. Chem. Phys. 2002, 275, 243-251. https://doi.org/10.1016/S0301-0104(01)00515-8
Gryglik D., Miller J.S., Ledakowicz S. Solar Energy 2004, 77, 615-623. https://doi.org/10.1016/j.solener.2004.03.029
Taniguchi M., Lindsey J.S. Chem. Rev. 2017, 117(2), 344-535. https://doi.org/10.1021/acs.chemrev.5b00696
Lindsey J.S. Chem. Rev. 2015, 115(13), 6534-6620. https://doi.org/10.1021/acs.chemrev.5b00065
Montforts F.-P., Gerlach B., Höper F. Chem. Rev. 1994, 94, 327-347. https://doi.org/10.1021/cr00026a003
Ma L., Dolphin D. J. Org. Chem. 1996, 61, 2501-2510. https://doi.org/10.1021/jo951854i
Gerlach B., Brantley S.E., Smith K.M. J. Org. Chem. 1998, 63, 2314-2320. https://doi.org/10.1021/jo9721608
Ma L., Dolphin D. Phytochemistry 1999, 50, 195-202. https://doi.org/10.1016/S0031-9422(98)00584-6
Ma L., Dolphin D. Tetrahedron Asymmetry 1995, 6, 313-316. https://doi.org/10.1016/0957-4166(95)00001-6
Tamiaki H., Kouraba M., Takeda K., Kondo Sh., Tanikaga R. Tetrahedron Asymmetry 1998, 9, 2101-2111. https://doi.org/10.1016/S0957-4166(98)00199-2
Porphyrins: Structure, Properties and Synthesis (Enikolopyan N.S., Ed.) Moscow: Nauka, 1985. 334 p. (in Russ.).
Gurinovich G.P., Sevchenko A.N., Solov'ev K.N. Spectroscopy of Chlorophyll and Its Related Compounds. Minsk: Nauka i Tekhnika, 1968. 518 p. (in Russ.).
Belykh D.V. Synthesis of Polyfunctional Chlorins Based on Methylpheophorbide a. Syktyvkar: KomiNC UrO RAN, 2012. 164 p. (in Russ.).
Khudyaeva I.S., Shevchenko O.G., Belykh D.V. Russ. Chem. Bull. 2020, 69(4), 742-750. https://doi.org/10.1007/s11172-020-2827-2
Karimov D.R., Makarov V.V., Kruchin S.O., Berezin D.B., Cmirnova N.L., Berezin M.B., Zheltova E.I., Strel'nikov A.I., Kustov A.V. Khimija Rastitel'nogo Syr'ja 2014, 189-196. (in Russ.). https://doi.org/10.14258/jcprm.201404310
Valverde J., This H. J. Agric. Food Chem. 2008, 56, 314-320. https://doi.org/10.1021/jf070277j
Mannina L., Segre A. Grasas y Aceites 2002, 53(1), 22-33. https://doi.org/10.3989/gya.2002.v53.i1.287
Jafari T., Durian G., Rahikainen M., Kortesniemi M., Kangasjärvi S., Sinkkonen J. Phytochem. Lett. 2017, 22, 13-20. https://doi.org/10.1016/j.phytol.2017.07.015
Fujii R., Kita M., Doe M., Iinuma Y., Oka N., Takaesu Y., Taira T., Iha M., Mizoguchi T., Cogdell R.J., Hashimoto H. Photosynth. Res. 2012, 111(1-2), 165-172. https://doi.org/10.1007/s11120-011-9698-1
Guadagno C.R., Della Greca M., De Santo A.V., D'Ambrosio N. Photosynth. Res. 2013, 115(1-2), 115-122. https://doi.org/10.1007/s11120-013-9833-2
Sobolev A.P., Brosio E., Gianferri R., Segre A.L. Magn. Reson. Chem. 2005, 43, 625-638. https://doi.org/10.1002/mrc.1618
Pollesello P., Toffanin R., Erikson O., Kilpeläinen I., Hynninen P.H., Paoletti S., Saris N.-E.L. Anal. Biochem. 1993, 214, 238-244. https://doi.org/10.1006/abio.1993.1483
Schoefs B. J. Chromatogr. A 2004, 1054, 217-226. https://doi.org/10.1016/j.chroma.2004.05.105
Mal'shakova M.V., Pylina Y.I., Belykh D.V. Bioorg. Med. Chem. Lett. 2019, 29, 2064-2069. https://doi.org/10.1016/j.bmcl.2019.07.019
Belykh D.V., Kozlov A.S., Pylina Y.I., Khudyaeva I.S., Benditkis А.S., Krasnovsky A.A. Macroheterocycles 2019, 12(1), 68-74. https://doi.org/10.6060/mhc190128b
Pylina Y.I., Startseva O.M., Rasova E.E., Belykh D.V. Macroheterocycles 2019, 12(2), 165-170. https://doi.org/10.6060/mhc181219b
Belykh D.V., Mazaletskaya L.I., Sheludchenko N.I., Rocheva T.K., Khudyaeva I.S., Buravlev E.V., Shchukina O.V., Chukicheva I.Yu. Molecules 2018, 23, 1718. https://doi.org/10.3390/molecules23071718
Kustov A.V., Belykh D.V., Smirnova N.L., Venediktov E.A., Kudayarova T.V., Kruchin S.O., Khudyaeva I.S., Berezin D.B. Dyes and Pigments 2018, 149, 553-559. https://doi.org/10.1016/j.dyepig.2017.09.073
Otvagin V.F., Nyuchev A.V., Kuzmina N.S., Grishin I.D., Gavryushin A.E., Romanenko Y.V., Koifman O.I., Belykh D.V., Peskova N.N., Shilyagina N.Yu., Balalaeva I.V., Fedorov A.Yu. Eur. J. Med. Chem. 2018, 144, 740-750. https://doi.org/10.1016/j.ejmech.2017.12.062
Nyuchev A.V., Otvagin V.F., Gavryushin A.E., Romanenko Y.I., Koifman O.I., Belykh D.V., Schmalz H.-G., Fedorov A.Yu. Synthesis 2015, 47(23), 3717-3726. https://doi.org/10.1055/s-0034-1378876
Santosh K.Bh., Raja R. Trends in Analytical Chemistry 2012, 35, 5-26. https://doi.org/10.1016/j.trac.2012.02.007
Holzgrabe U. Prog. Nucl. Magn. Reson. Spectrosc. 2010, 57, 229-240. https://doi.org/10.1016/j.pnmrs.2010.05.001