«Умный» фотосенсибилизатор хлорин е6: роль кислотно-основной ионизации
Аннотация
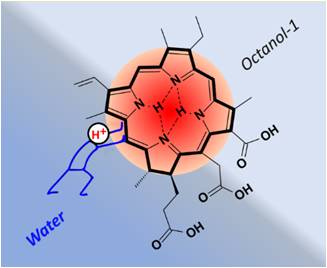
Фотосенсибилизатор Хлорин е6 можно назвать даром природы для фотодинамической тераностики опухолей различной локализации. Он удовлетворяет практически всем основным требованиям, предъявляемым к оптимальному фотосенсибилизатору, основанным на фотофизических, биологических и химико-технологических критериях, которые были сформулированы учеными и специалистами в результате анализа большого объема экспериментальных и клинических материалов. Настоящая работа посвящена теоретическому и экспериментальному исследованию кислотно-основных свойств хлорина е6, которые непосредственно связаны с его взаимодействием с транспортными белками, липидной мембраной и везикулами- рецепторами на протяжение всего пути от иньекции PS в кровоток до опухоли-мишени и ее органелл. В общем случае в зависимости от рН молекула хлорина е6 может подвергаться пошаговой кислотно-основной ионизации по трем периферийным карбоксильным группам и по одному внутрициклическому атому азота хлориновой платформы, образуя череду амфифильных ионов. Протонирование хлориновой платфлормы, сопровождается четким оптическим откликом и оказывает непосредственное влияние на спектры поглощения и флуоресценции этого PS, которые связанные с его фототоксичностью в условиях ФДТ, а также на его агрегационное соcтояние и липофильность. Полученные результаты были согласованы и консолидированы с литературными данными по кислотно-основной ионизации трех периферийных карбоксильных групп хлорина е6, а затем были использованы для количественной интерпретации коэффициентов его межфазного распределения между октанолом-1 и PBS. Сделан вывод, что протонирование хлориновой платформы является причиной высокой селективности накопления фотосенсибилизатора Fotoditazin® в тканях злокачественных новообразований.
Литература
Gilyadova A., Ishchenko A., Shiryaev A., Alekseeva P., Efendiev K., Karpova R., Loshchenov M., Loschenov V., Reshetov I. Cancers (Basel) 2022, 14(1), 211. https://doi.org/10.3390/cancers14010211
Hak A., Ali M.S., Sankaranarayanan S.A., Shinde V.R., Rengan A.K. ACS Appl. Bio Mater. 2023, 6, 349–364. https://doi.org/10.1021/acsabm.2c00891
Ni J., Yin X., Liao S., Cai M., Zhu R., Fu T., Du Y., Kong J., Zhang Y., Qu C., Dong X. Mol. Pharmaceutics 2023, 20, 875–885. https://doi.org/10.1021/acs.molpharmaceut.2c00824
da Vicente M.G.H., Smith K.M. Molecules. 2023, 28, 3479. https://doi.org/10.3390/molecules28083479
Yu H., Huang Z., Wu J., Zhao Z., Hua Y., Yang Y. Nanomedicine 2025, 20, 389–400. https://doi.org/10.1080/17435889.2025.2456450
Kustov A.V. ChemChemTech 2023, 66(12), 32–40. https://doi.org/10.6060/ivkkt.20236612.6902
Berezin D.B., Bondareva T.V., Shukhto O.V., Kustova T.V., Razgovorov P.B., Kustov A.V. ChemChemTech 2025, 68(6), 70–82. https://doi.org/10.6060/ivkkt.20256806.7166
Parkhats M.V., Galievskii V.A., Zharnikova E.S., Knyukshto V.N., Lepeshkevich S.V., Stashevskii A.S., Trukhacheva T.V., Dzhagarov B.M. J. Appl. Spectrosc. 2011, 78, 278–285. https://doi.org/10.1007/s10812-011-9459-0
do Amaral S.R., Aires-Fernandes M., Haddad F.F., Gini A.L.R., Scarim C.B., Primo F.L. Molecules 2025, 30(3), 544. https://doi.org/10.3390/molecules30030544
Isakau H.A., Parkhats M.V., Knyukshto V.N., Dzhagarov B.M., Petrov E.P., Petrov P.T. J. Photochem. Photobiol. B Biol. 2008, 92(3), 165–174. https://doi.org/10.1016/j.jphotobiol.2008.06.004
Losytskyy M.Y., Kharchenko R.A., Harahuts Y.I., Virych P.A., Kutsevol N.V., Yashchuk V.M. Funct. Mater. 2020, 27, 12–17. https://doi.org/10.15407/fm27.01.12
Fernandez J.M., Bilgin M.D., Grossweiner L.I. J. Photochem. Photobiol. B Biol. 1997, 37, 131–140. https://doi.org/10.1016/S1011-1344(96)07349-6
Parkhats M.V., Galievsky V.A., Stashevsky A.S., Trukhacheva T.V., Dzhagarov B.M. Opt. Spectrosc. 2009, 107, 974–980. https://doi.org/10.1134/S0030400X09120200
Concentrate for preparation of infusions solution. https://fotoditazin.com/produktsiya/?ELEMENT_ID=24 (accessed 2025-08-01).
Global Spirulina Market - 2025-2032. https://www.market-research.com/DataM-Intelligence-4Market-Research-LLP-v4207/Global-Spirulina-41227043/ (accessed 2025-08-01).
Čunderlíková B., Gangeskar L., Moan J. J. Photochem. Photobiol. B Biol. 1999, 53, 81–90. https://doi.org/10.1016/S1011-1344(99)00130-X
Čunderlíková B., Kongshaug M., Gangeskar L., Moan J. Int. J. Biochem. Cell Biol. 2000, 32, 759–768. https://doi.org/10.1016/S1357-2725(00)00015-7
Mojzisova H., Bonneau S., Vever-Bizet C., Brault D. Biochim. Biophys. Acta - Biomembr. 2007, 1768, 366–374. https://doi.org/10.1016/j.bbamem.2006.10.009
Mojzisova H., Bonneau S., Vever-Bizet C., Brault D. Biochim. Biophys. Acta - Biomembr. 2007, 1768, 2748–2756. https://doi.org/10.1016/j.bbamem.2007.07.002
Zorin V.P., Michalovsky I., Zorina T.E., Khludeyev I.I. Proc. SPIE 2625, Photochemotherapy: Photodynamic Therapy and Other Modalities 1996, 2625, 146–155. https://doi.org/10.1117/12.230981
Gullino P.M., Grantham F.H., Smith S.H., Haggerty A.C. J. Natl. Cancer Inst. 1965, 34, 857–869. https://doi.org/10.1093/jnci/34.6.857
Thistlethwaite A.J., Leeper D.B., Moylan D.J., Nerlinger R.E. Int. J. Radiat. Oncol. 1985, 11, 1647–1652. https://doi.org/10.1016/0360-3016(85)90217-2
Wike-Hooley J.L., Haveman J., Reinhold H.S. Radiother. Oncol. 1984, 2, 343–366. https://doi.org/10.1016/S0167-8140(84)80077-8
Kuzelova K., Brault D. Biochemistry 1995, 34, 11245–11255. https://doi.org/10.1021/BI00035A034
Moan J., Smedshammer L., Christensen T. Cancer Lett. 1980, 9, 327–332. https://doi.org/10.1016/0304-3835(80)90025-7
Thomas J.P., Girotti A.W. Photochem. Photobiol. 1989, 49, 241–247. https://doi.org/10.1111/J.1751-1097.1989.TB04102.X
Falk J.E. In: Porphyrins and Metalloporphyrins (Smith K.M., Ed.), Elsevier Science Ltd, 1975.
Zharov E., Zharov I., Loginov F. Method of Producing Tris-sodium Salt of Chlorin e6, 2019. https://patents.google.com/patent/RU2705199C1/en (accessed 2025-08-02).
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., et al. Gaussian 09. Gaussian, Inc., Wallingford CT, 2009.
Sheinin V.B., Ivanova Y.B. Russ. J. Phys. Chem. A 2007, 81, 1250–1255. https://doi.org/10.1134/S0036024407080134
Sheinin V. B., Ivanova Y. B. Russ. J. Inorg. Chem. 2005, 50, 1098–1107.
Sheinin V.B., Kulikova O.M., Koifman O.I. Macroheterocycles 2018, 11, 363–370. https://doi.org/10.6060/mhc181109S
Sheinin V.B., Kulikova O.M., Koifman O.I. J. Mol. Liq. 2019, 277, 397–408. https://doi.org/10.1016/j.molliq.2018.12.105
Sheinin V.B., Ratkova E.L., Mamardashvili N.Z. J. Porphyrins Phthalocyanines 2008, 12, 1211–1219. https://doi.org/10.1142/S1088424608000595
Sheinin V.B., Simonova O.R., Ratkova E.L. Macroheterocycles 2008, 1, 72–78. https://doi.org/10.6060/mhc2008.1.72
Sheinin V.B., Kulikova O.M. Dyes Pigm. 2021, 194, 109589. https://doi.org/10.1016/j.dyepig.2021.109589
Sheinin V.B., Ivanov D.A., Koifman O.I. Macroheterocycles 2017, 10, 487–495. https://doi.org/10.6060/mhc170833s
Sheinin V.B., Bobritskaya E.V., Shabunin S.A., Koifman O.I. Macroheterocycles 2014, 7, 209–217. https://doi.org/10.6060/mhc141033s
Sheinin V.B., Shabunin S.A., Bobritskaya E.V., Ageeva T.A., Koifman O.I. Macroheterocycles 2012, 5, 252–259. https://doi.org/10.6060/mhc2012.120989S
Sheinin V.B., Shabunin S.A., Bobritskaya E.V., Koifmana O.I. Macroheterocycles 2011, 4, 80–84. https://doi.org/10.6060/mhc2011.2.02
Sheinin V.B., Ivanova Y.B., Berezin B.D. Russ. J. Gen. Chem. 2002, 72, 1128–1131. https://doi.org/10.1023/A:1020719303646/METRICS
Izutsu K. Electrochemistry in Nonaqueous Solutions, Wiley‐VCH Verlag GmbH & Co. KGaA, 2002. https://doi.org/10.1002/3527600655
Vermathen M., Marzorati M., Vermathen P., Bigler P. Langmuir 2010, 26, 11085–11094. https://doi.org/10.1021/la100679y
Hynninen P.H. J. Porphyrins Phthalocyanines 2014, 18, 385–395. https://doi.org/10.1142/S1088424614500126
Hynninen P.H. J. Porphyrins Phthalocyanines 2012, 16, 1167–1176. https://doi.org/10.1142/S1088424612501167
Hynninen P.H. J. Chem. Soc. Perkin Trans. 2 1991, 2, 669–678. https://doi.org/10.1039/p29910000669
Brault D., Vever-Bizet C., Le Doan T. Biochim. Biophys. Acta - Biomembr. 1986, 857, 238–250. https://doi.org/10.1016/0005-2736(86)90352-4
Saini R.K., Dube A., Gupta P.K., Das K. J. Phys. Chem. B 2012, 116, 4199–4205. https://doi.org/10.1021/JP205335Z
Khludeev I.I., Kozyr’ L.A., Zorina T.E., Zorin V.P. Bull. Exp. Biol. Med. 2015, 160, 208–212. https://doi.org/10.1007/S10517-015-3130-3
Kustov A.V., Berezin D.B., Zorin V.P., Morshnev P.K., Kukushkina N.V., et al. Pharmaceutics 2023, 15, 61. https://doi.org/10.3390/pharmaceutics15010061
Kustov A.V., Morshnev P.K., Kukushkina N.V., Smirnova N.L., Berezin D.B., et al. Int. J. Mol. Sci. 2022, 23, 5294. https://doi.org/10.3390/ijms23105294
Douillard S., Lhommeau I., Olivier D., Patrice T. J. Photochem. Photobiol. B Biol. 2010, 98, 128–137. https://doi.org/10.1016/j.jphotobiol.2009.11.011
Scolaro L.M., Castriciano M., Romeo A., Patanè S., Cefalì E., Allegrini M. J. Phys. Chem. B 2002, 106, 2453–2459. https://doi.org/10.1021/jp013155h
Martin R.B. Science 1963, 139, 1198–1203. https://doi.org/10.1126/science.139.3560.1198.
Donder T., Van Rysselberghe P. Thermodynamic Theory of Affinity: A Book of Principles, Stanford University Press, 1936.